【摘要】探讨microRNA.143(miR.143)对白介素13(IL.13)诱导的人角质形成细胞组织激肽释放酶7(KLK7)表达的影响。方法取对数生长期人皮肤原代角质形成细胞(NHEK),分别用0、2、10、50i-Lg/LIL.13处理24h,或用50斗g/LIL.13分别处理0、6、12、24、48h后,收集细胞,提取细胞总RNA,实时荧光定量PCR检测KLK7基因mRNA水平。再取部分NHEK,分为4组,即NHEK组(空白对照组,既不转染也不用IL.13刺激)、IL一13组(仅用50斗g,LIL.13处理)、miR—NC组(转染microRNAmimics阴性对照后用50“f;/LIL.13处理)和miR一143组(转染miR.143mimics后用50p.g/LIL.13处理),IL.13处理24h后,实时荧光定量PCR检测各组中KLK7mRNA的相对表达水平,Western免疫印迹检测KLK7蛋白表达水平。结果0、2、10、50p班IL一13处理NHEK24hA,KLK7mRNA的相对表达水平分别为1.00±0.12、0.89±0.04、1.15±0.09和1.70±0.10,随着IL一13浓度的升高,KLK7mRNA相对表达水平有上升趋势(F=92.48,P<0.05)。50州LIL.13分别处理NHEK0、6、12、24、48h后,KLK7mRNA相对表达水平分别为1.00±0.05、1.05±0.12、1.71±0.20、1.97±0.19和2.48±0.13,随着IL.13处理时间延长,KLK7mRNA的相对表达水平有上升趋势(F=206.44,P<0.05)。与miR—NC组KLK7的mRNA和蛋白相对表达水平相比,miR.143组均降低,差异有统计学意义(t值分别为6.76、4.23,均P<0.05)。结论在人角质形成细胞中,IL一13上调KLK7的表达可能与miR.143的调控相关。
【关键词】皮炎,特应性,角质形成细胞,白细胞介素13,组织激肽释放酶7,微RNA.143
特应性皮炎(AD)是一种慢性炎症性皮肤病,临床特征为严重瘙痒和复发性湿疹样皮损n]。AD发病机制主要包括表皮屏障结构和功能异常以及免疫功能紊乱,在AD的发病过程中,二者存在相互作用、互为因果的联系陋1。本课题组的前期研究证实,白介素13(IL.13)可以下调角质形成细胞中表皮屏障相关蛋白如丝聚合蛋白、兜甲蛋白和内披蛋白的表达,而上调角质形成细胞中microRNA一143(miR一143)的表达则可逆转IL一13对以上3种蛋白表达的影响b1。我们拟在前期工作基础上,探讨miR.143是否可以影响IL.13诱导的组织激肽释放酶7(kallikrein7,KLK7)的表达,为miR.143在AD发病中的作用提供更多的理论依据。
材料与方法
一、细胞系、试剂和仪器
正常人皮肤原代角质形成细胞(primarynormalhumanepidermalkeratinocytes,NHEK)、无血清角质形成细胞培养基(德国PromoCell公司),重组人IL.13蛋白(美国RD公司),反转录试剂盒、超级ECL发光试剂盒(美国ThermoFisher公司),TrizolRNA提取液、脂质体转染试剂Lipofectamine2000(美国Invitrogen公司),SYBRGreenqPCRMix(广州东盛生物科技有限公司),miR.143mimics、miR.NC(microRNAmimics阴性对照)(广州锐博生物科技有限公司),Bradford蛋白浓度测定试剂盒、iQ5实时荧光定量PCR仪(美国Bio—Rad公司),抗KLK7抗体(美国SantaCruz公司)、3磷酸甘油醛脱氢酶(GAPDH)抗体(天津三箭生物技术有限公司),天能Tanon4200全自动化学发光成像分析系统(上海天能科技有限公司)。
二、方法
1.细胞培养和分组:NHEK常规复苏成功后,用无血清角质形成细胞培养基于37℃、5%CO:培养箱中培养,细胞传至3至5代时,取对数生长期细胞接种于12孔培养板中(1×105/孔),接受以下分组处理。①加人终浓度分别为0、2、10、50¨g,L的IL—13,继续孵育24h后终止培养;②加入50斗g,LIL.13,分别孵育0、6、12、24、48h后终止培养。以上两部分实验每组设3个复孔,终止培养后收集细胞,采用Trizol法提取细胞总RNA用于后续实验。
2.细胞转染:在转染前1d,用胰蛋白酶消化细胞后,以3×105个/孑L接种于6孔板,37c|c、5%CO:培养,使转染前细胞融合度为70%一80%。转染当天,换新鲜无抗生素完全培养基,37℃孵育,转染前拍照记录。采用Lipofectamine2000将miR.143mimics和miR.NC分别转染人NHEK,24h后用荧光显微镜观察细胞转染效率(荧光细胞比例超过80%认为达到转染要求),拍照记录。NHEK分为4组,@NHEK组:不接受转染或IL.13刺激;②IL一13组:仅用50txg/LIL.13处理;③miR—NC组:转染microRNAmimics阴性对照24h后用50¨∥LIL.13处理;@miR.143组:转染miR.143mimics24h后用50州LIL.13处理,孵育24h,每组设3个复孑L。收集细胞,分别提取细胞总RNA和总蛋白,用于后续实验。
3.实时荧光定量PCR检测KLK7基因mRNA水平:采用反转录试剂盒,按照标准实验流程将上述实验中提取的总RNA反转录为cDNA,按SYBRGreenqPCRMix试剂盒按说明书扩增目的基因。反应体系如下:cDNA模板5斗l,正反向引物各0.5斗l,2×SYBRGreenqPCRMix10Ixl,去离子水4斗l,最终反应体积20斗l。引物序列:KLK7正向引物57.GTGACTCAGGGGGACCGTT一37,反向引物5’一TCAGTGTGGCGlTrAGCGAT.37;B肌动蛋白正向引物57一GCACCCAGCACAATGAAGA.37,反向引物5’.AATAAAGCCATGCCAATCTCA.3’。PCR反应条件:95cC预变性2min;95℃变性15S,60oC退火20S,72℃延伸20S,共40个循环。以B肌动蛋白为内参照,记录各实验孑LCt值,以2-aac,表示目的基因的相对表达水平。
4.免疫印迹实验检测KLK7蛋白水平:采用Bradford蛋白浓度测定试剂盒测定上述实验中提取蛋白样本浓度。制备聚丙烯酰胺凝胶,上样,电泳,转膜。采用封闭液室温封闭PVDF膜1h,用新鲜配制的封闭液稀释一抗(抗体稀释比例KLK71:200,GAPDH1:3000),4oC过夜9呼育。洗膜后加入二抗(稀释比均为1:3000),室温孵育PVDF膜1h。以GAPDH为内参蛋白。洗膜后采用超级ECL发光试剂盒化学发光,在化学发光成像分析系统中显影。实验重复3次。使用ImageJ1.51k软件测量目的蛋白条带的灰度值,并与GAPDH蛋白条带的灰度值对比,计算目的蛋白相对表达水平。
5.统计学方法:采用SAS9.4统计软件分析。计量资料服从正态分布者采用孑±S进行统计学描述。KLK7mRNA的相对表达水平与IL.13处理浓度和处理时间的趋势性采用线性趋势检验。两组间比较采用独立样本t检验,多组间比较首先采用单因素方差分析,再采用LSD—t检验进行两两间多重比较。P<0.05为差异有统计学意义。
结果
一、不同浓度IL—13对NHEK中KLK7基因mRNA水平的影响
0、2、10、50I山g/LIL.13组KLK7mRNA的相对表达水平分别为1.00±0.12、0.89±0.04、1.15±0.09、1.70±0.10,线性趋势检验发现,IL—13浓度与KLK7mRNA相对表达水平之间有线性关系(F=92.48,P<0.05),随着IL.13浓度升高,KLK7mRNA相对表达水平有上升趋势。
二、IL.13处理NHEK不同时间对KLK7基因mRNA水平的影响
50txg/LIL一13处理0、6、12、24和48h后KLK7mRNA相对表达水平分别为1.00±0.05、1.05±0.12、1.71±0.20、1.97±0.19、2.48±0.13。线性趋势检验发现,IL.13处理时间与KLK7mRNA的相对表达水平之间有线性关系(F=206.44,P<O.05),随着50Ixg/LIL一13处理时间延长,KLK7mRNA的相对表达水平有上升趋势。
三、miR.143对NHEK中IL.13诱导的KLK7mRNA和蛋白表达水平的影响
1.转染效率:转染NHEK24h后,与明视场显微镜下对比,荧光显微镜观察同一视野下荧光细胞比例大于90%,故认为转染成功。
2.KLK7mRNA表达水平比较:见表l。与NHEK组相比,IL.13组KLK7mRNA相对表达水平升高(t=7.12,P<0.05)。单因素方差分析显示,IL.13组、miR.NC组和miR.143组间KLK7mRNA相对表达水平差异有统计学意义(F=26.89,P<0.05),而il一13组和mir.nc组间差异无统计学意义(t=0.91,p>0.05),miR一143组低于IL.13组和miR.NC组,差异均有统计学意义(仁5.85、6.76,均P<0.05)。
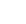
3.KLK7蛋白表达水平比较:见表1、图1。与NHEK组相比,IL.13组KLK7蛋白相对表达水平升高(t=4.85,P<0.05)。单因素方差分析显示,IL—13组、miR—NC组和miR一143组间KLK7蛋白相对表达水平差异有统计学意义(F=13.26,P<0.05),而il一13组和mir—nc组间差异无统计学意义(t=o.42,p>0.05),miR一143组低于IL.13组和miR.NC组,差异均有统计学意义(t=4.65、4.23,均P<0.05)。
讨论
目前认为,Th2型免疫反应在AD免疫功能紊乱中发挥主导作用,其中Th2型细胞因子如IL.4和IL.13起关键作用。2。针对IL.4和IL.13共同受体IL一4Ra的生物制剂Dupilumab,目前已在美国上市,成为首个获批治疗AD的生物制剂。4,这也显示IL一4和IL—13在AD发病中的核心作用。
KLK在皮肤中最主要的生理功能为促进皮肤脱屑,通过降解桥粒芯糖蛋白1、桥粒芯胶蛋白1和角质层锁链蛋白来促进浅层角质形成细胞脱落,从而维持皮肤稳态,5。KLK7是第一个从角质层中以活化形式鉴定出来的KLK,也是表皮中唯一的糜蛋白酶。既往研究表明,KLK7转基因小鼠模型可呈现AD的临床特征。与健康对照组比较,AD患者表皮KLK7蛋白表达水平升高,蛋白酶活性增强。最新研究发现,若婴儿出生时表皮KLK7酶活性升高,可能与其日后发生皮肤屏障功能损伤和AD相关。以上研究提示,降低KLK7的表达或阻断其过度活化的酶活性可作为AD的治疗策略之一。
体外实验表明,IL一4和IL.13可以诱导NHEK或HaCaT细胞中KLK7mRNA和蛋白水平升高,酶活性增强’8·12。13;。提示在AD中,KLK7的表达和活性除了受蛋白酶抑制剂和各种理化因素影响外,还可能与机体的免疫功能紊乱,特别是Th2型免疫反应相关。但是,Th2型细胞因子调控KLK7表达的具体机制目前尚无报道。本研究结果显示,随着IL—13处理时间的延长和浓度升高,KLK7mRNA表达均呈上升趋势,提示在体外实验中,KLK7表达与IL一13浓度和作用时间密切相关。
本研究结果显示,在NHEK中过表达miR一143可逆转IL.13对KLK7上调表达的效应。由于IL一13Ra1是IL.13的重要受体之一,结合本课题组前期工作可以推测,miR.143针对KLK7表达的上述效应,也可能是通过直接负向调控IL一13Rcd来实现的。