【摘要】目的观察以人羊膜为基质、自体与异体细胞混合构建的活性皮肤替代物(AM.LSE)修复大疱性表皮松解症患者手部瘢痕挛缩的疗效。方法采集1例隐性营养不良型大疱性表皮松解症(RDEB)患者及其母亲的皮肤组织,分别进行表皮角质形成细胞和真皮成纤维细胞分离、培养。将白体与异体细胞混合后构建AM—LSE并进行组织学检查和Ⅶ型胶原免疫荧光检查。移植AM.LSE皮片于RDEB患者手部瘢痕挛缩松解术后的皮肤缺损区域。术后观察皮片的成活以及创面修复效果。结果构建的AM—LSE具有真皮层、重层分化良好的表皮层和发育完好的基底膜。免疫荧光检查显示,Ⅶ型胶原沿基底膜线性分布。术后观察半年,移植的AM.LSE存活良好,未发现明显的排异反应,未发现受皮区再发水疱及破溃,瘢痕挛缩不显著,皮片色泽接近正常皮肤,质地柔软,患手可抓握,满足一般生活自理的要求。结论自体与异体细胞混合构建的AM—LSE具有良好的组织学形态,移植于RDEB患者瘢痕切除后的创面,无明显排异,不易因摩擦起水疱破溃或发生瘢痕挛缩。
【关键词】营养不良性大疱性表皮松解,皮肤,人工,皮肤移植,移植,同种,挛缩,活性皮肤替代物,自体与异体细胞
隐性营养不良性大疱性表皮松解症(recessivedystrophicepidermolysisbullosa,RDEB)是大疱性表皮松解症中最严重的亚型,皮肤反复发生水疱、破溃,也可导致食道狭窄、小口畸形、全身广泛瘢痕形成[1]。手部瘢痕挛缩畸形往往较为严重,由于表皮包裹,形成“拳击手套”样改变,严重影响生活工作质量,治疗主要是瘢痕松解和自体皮片移植。自体皮片虽然来自未受损区域,但细胞编码Ⅶ型胶原基因仍然异常,移植后在摩擦和微小的创伤下皮肤会频繁发生水疱、破溃和瘢痕挛缩,且患者自身无法反复提供全厚皮片。在病损面积较大、自体可用供皮面积不足的情况下,可采用自体皮肤细胞构建的活性皮肤替代物(1ivingskinequivalent,LSE)修复创面[2]。有实验表明,异体成纤维细胞皮内注射后无明显的排异反应,并可以合成分泌Ⅶ型胶原分布到基底膜区域,形成良好的基底膜一真皮连接b]。我们检测1例RDEB患者直系亲属(生母)的皮肤,证实其有正常的Ⅶ型胶原分布,然后将患者和其母亲的皮肤细胞混合,构建基底膜有Ⅶ型胶原分布的LSE来移植修复患者手部瘢痕挛缩松解后的皮肤缺损创面并定期随访,评估自体与异体细胞混合构建的LSE治疗基因缺陷型表皮松解症的效果。
资料与方法
一、临床资料
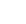
患者女,22岁,自出生后全身多处皮肤在摩擦后反复出现表皮松解、水疱形成。右手逐渐形成瘢痕挛缩,影响功能。数年前来我院皮肤科及整形外科就诊,行病理学检查,确诊为RDEB,并行瘢痕松解、自体全厚皮移植术。数月后术区因再次反复水疱破溃、愈合,形成瘢痕挛缩(图1)。体检:枕部、腰背部易摩擦部位大片瘢痕,手足瘢痕挛缩畸形。右手2~4指瘢痕粘连挛缩,掌指关节、指指关节屈曲畸形,不能伸直,抓握功能受限。
二、治疗方法
我们采用自体及直系亲属细胞培养构建的LSE修复创面,该方案经汕头大学医学院第二附属医院伦理委员会批准,患者及家属均签署知情同意书。
1.细胞培养:局麻下切取患者及生母上臂内侧各约1em2正常皮肤,在超净工作台上剔除脂肪,修薄真皮部分后放人分散酶(O.4g/L)溶液中,4℃静置过夜,分离表皮和真皮。置表皮片于2.5g/L胰蛋白酶溶液中,37℃处理10min,获得表皮角质形成细胞悬液,种于I型胶原涂布的培养皿(日本1waki公司),添加Epilife表皮角质形成细胞培养基(美国Lifescience公司),于CO:培养箱中常规培养,细胞达到90%融合时传代。将表皮层剥离后的真皮切成直径1。2mm的组织块,使其紧密贴附于培养皿的底部,添加2%患者自身血清于低血清间充质细胞培养基(MeSup,广州美萨生物科技有限公司)中,于5%CO:细胞培养箱中常规培养,5d后成纤维细胞自真皮组织块的周围长出并增殖、游走,细胞达到90%融合时,进行传代培养。
将3代前的表皮角质形成细胞和4代前的真皮成纤维细胞冻存于液氮中。使用前进行细胞复苏、接种、培养,达到约90%融合后,收集细胞,利用第4代表皮角质形成细胞和第5代成纤维细胞构建活性全层皮肤LSE。
2.构建以羊膜amnion,AM)为基质的活性皮肤替代物(AM.LSE):羊膜来自足月健康剖宫产产妇(与患儿无亲缘关系)胎盘,在超净工作台上清洗去除血液、蜕膜等。将羊膜置于0.02%乙二胺四乙酸中37qC孵育30min后,在解剖显微镜下用细胞刮子刮除羊膜上皮,清洗,修剪成5am×5am大小羊膜片,4℃冷藏备用。羊膜供体签署知情同意书授权使用。在添加自体人血清(2%)的MeSup培养基中,调整成纤维细胞密度为5×105个/ml(自体及亲属细胞比例为l:1)。将该细胞混悬液以0.5ml/cm2滴注在羊膜基质面,静置2h,待细胞贴壁后,添加培养基,于5%CO:细胞培养箱中培养。2d后,翻转接种了成纤维细胞的羊膜使上皮面朝上,置于Transwell嵌入式膜培养皿(直径75mm,膜孑L径3斗m,美国Corning公司)上,在上皮面滴注表皮角质形成细胞悬液(自体及亲属细胞比例为1:1),浓度l×106个/ml,密度0.5ml/cm2。液相下培养2d,待细胞达到融合后,换气液面角化培养基,开始气液面培养,每2天换液1次。
3.组织学和免疫荧光观察:来自RDEB患者和其母亲的活检皮肤标本及气液面培养10d的AM—LSE标本石蜡包埋,制作6cm厚石蜡切片,行HE染色以及Ⅶ型胶原抗体(LH7.2,美国NeoMarker公司)免疫荧光染色。
4.AM.LSE皮片移植修复创面:臂丛麻醉,切除手掌部瘢痕,松解挛缩,充分止血后,覆盖皮耐克人工皮(Pelnac,日本Gunze公司)(图2A),2周后去除皮耐克的硅胶膜,刮除水肿老化的肉芽组织,创面充分止血(图2B);将AM.LSE以生理氯化钠溶液漂洗多次,洗去培养基成分后,裁剪成邮票状,贴敷于创面,网眼纱固定皮片后(图2c、2D),填塞纱布碎片,打包包扎。术后7d拆除敷料,常规换药直至AM.LSE皮片完全封闭创面。2个月后再次行分指手术(图3),创面行多z成形并用自体与异体细胞混合AM.LSE覆盖,术后常规更换敷料至伤口完全愈合。
结果
一、Ⅶ型胶原免疫荧光染色结果
患者母亲皮肤Ⅶ型胶原正常表达,沿基底膜线性分布,而患者皮肤未见Ⅶ型胶原表达。
二、AM.LSE的大体和组织学观察
气液面培养10d后,羊膜表面为角化表皮层,呈淡黄色,AM.LSE质地较韧,可牵拉不易破损(图2C)。组织学观察:表皮角质形成细胞重层化、分化,基底细胞层排列规整紧密,上方可见棘细胞层、颗粒细胞层以及角质层。成纤维细胞向羊膜基质内浸润生长(图4A)。免疫荧光染色可见明显的Ⅶ型胶原沿基底膜呈线性分布(图4B)。
三、术后观察
术后7d,AM.LSE与创基贴敷牢固,皮片红润,完全覆盖创面,未发现皮片移植区域新发生的水疱及破溃;术后2周,移植的AM.LSE皮片贴敷牢固,质地柔软,色泽与周边皮肤没有明显差别,可完成握拳动作(图5A、5B)。分指多z成形、自体与异体AM.LSE移植术后6周,未观察到移植区域排异反应、水疱形成及皮肤破溃(图5C、5D),掌指、指指关节可自主活动,未见挛缩。术后8个月回访,手部移植的AM.LSE皮片色泽接近正常皮肤,质地柔软,未见明显的瘢痕挛缩,患手可抓握,满足生活自理的一般要求(图5E、5F)。术后1年余电话随访,诉手部摩擦后偶有水疱形成,常规换药后可自愈,手部抓握功能尚可。
讨论
应用表皮、真皮成纤维细胞,以I型胶原为真皮基质构建LSE.51是目前多数实验室和生物医学研究机构采用的技术,并获得美国和中国食品药品监督管理局认证。我们研究发现,去上皮化人羊膜基质层可以容纳成纤维细胞的三维立体生长,上皮面因为保留了基底膜的基本成分,可更好地支持表皮角质形成细胞贴附生长,构建的AM—LSE具有更紧密排列的表皮基底细胞层、重层分化良好的表皮结构和发育良好的基底膜,表皮真皮连接更加紧密,较I型胶原构建的LSE可发育出更为成熟的基底膜以及基底细胞和基底膜的紧密连接,Ⅶ型胶原的分布也更接近正常皮肤,且更易操作,移植于裸鼠背部创面,长期存活哺。7j。在LSE的构建过程中,采用无动物源成分的培养基以及弃用动物来源的I型胶原,使AM—LSE具备了更好的临床适用性。
本例患者自出生以来全身皮肤反复广泛出现摩擦后水疱以及瘢痕形成,综合临床表现和相关实验室检查诊断为RDEB。3年前该RDEB患者曾接受手部瘢痕挛缩松解、自体全厚皮移植术,术后3个月,移植皮片反复发生水疱、破溃,再次形成瘢痕挛缩畸形。由于从无皮损区域采集的自体皮片同样在基底膜区无Ⅶ型胶原构成的锚原纤维,轻微外力下容易形成基底膜下分离出现水疱;而且,患者的头枕部、腰背部、手足等易摩擦部位反复破溃,形成瘢痕,难以反复提供可行皮片移植的供皮区。故我们决定采用体外构建活性皮肤替代物进行瘢痕切除松解后的皮肤缺损修复。患者生母的皮肤组织Ⅶ型胶原沿基底膜走行,表达正常,无皮肤摩擦起疱病史。为了避免可能的排异反应,我们采集患者生母的皮肤细胞并将其与患者皮肤细胞混合,以人羊膜为基质构建LSE。该LSE中可见沿基底膜线性分布的Ⅶ型胶原。AM.LSE气液面培养7。21d,LSE能够维持良好的组织学形态,为手术时间安排提供了较大的窗口期。
应用以共价交联牛胶原为主要成分的Integra等真皮支架覆盖创面不仅可以提高瘢痕组织、慢性创面的受皮成功率,而且可以减少瘢痕形成、皮片挛缩,获得较好的柔软度和外观随圳。皮耐克具有比Integra更弱的抗原性,创面的成纤维细胞和新生血管向皮耐克的基质层长人,形成一定厚度的肉芽组织,在其上移植薄断层皮片可以达到较好的效果,减少肉芽创面薄断层皮片移植后的瘢痕挛缩和色素沉着。应用皮耐克覆盖手部瘢痕切除松解后的创面,2周后在揭去硅胶膜后的肉芽创面上移植AM—LSE皮片。AM—LSE联合皮耐克修复的创面色泽和柔软度都接近正常皮肤。健康异体和RDEB患者细胞混合构建的AM.LSE中,Ⅶ型胶原表达良好,移植后8个月未出现水疱及破溃,较之RDEB患者自体全厚皮移植显示出较强的抗摩擦性,且可以反复多次制备,提供皮源。遗感的是,术后8个月回访时,我们未能征得患者及家属的同意进行活检来了解AM—LSE植皮手术区域Ⅶ型胶原的表达情况。自体与异体细胞AM.LSE移植后未发现明显的排异反应,可能与表皮角质形成细胞和真皮成纤维细胞的抗原性较弱、没有具抗原提呈特性的朗格汉斯细胞和血管内皮细胞等的参与”2。引以及异体细胞来自直系亲属有关。
以人去上皮羊膜为基质构建的LSE,具有发育良好的基底膜结构和更为紧密的表皮真皮连接;携带的正常异体皮肤细胞具有合成分泌正常Ⅶ型胶原、构建基底膜和表皮真皮连接的能力。在修复本例RDEB患者的手术创面方面,自体与异体细胞混合构建的AM—LSE优于RDEB患者自体皮片,但其长远效果还有待进一步实践检验。